基因與癌症
資料提供/更新:盧煜明教授
醫學院副院長 (研究)
化學病理學系系主任
訪問:王榮珍女士
資料整理:陳瓏醫生
林善雅女士


簡介:
相信很多朋友都聽過染色體、DNA和基因這些名詞,但事實上他們是什麼呢?和癌症又有什麼關係呢?在這篇文章盧煜明教授用深入淺出的方法替我們詳細解釋,令我們不單了解這些名詞的意義,還令我們知道癌症的成因和可以如何盡量避免。
第一部份——什麼是染色體、DNA和基因
第二部份——從基因角度解釋人為什麼會生癌?
第三部份——如何用基因技術來確診/監察/治療癌症?
第四部份——展望未來
第一部分——什麼是染色體、DNA和基因
什麼是染色體、DNA及基因
(1) 大部分的細胞 (cell) 都有DNA,但是也有例外的,例如紅血球。
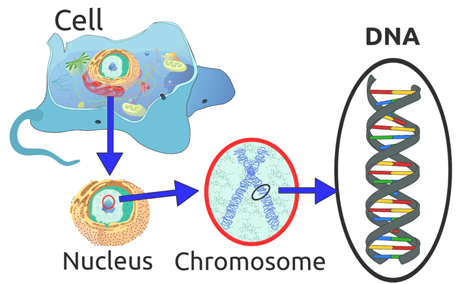
(2) 大部分的細胞都有一個細胞核 (nucleus)。
(3) 細胞核內藏 23 對染色體 (Chromosomes),它們是以長度來區分 ── 最長的是 Chromosome 1、比較短的是 Chromosome 21,有22對常染色體(Autosomes) 及一對性別染色體 (Sex Chromosome, X, Y),男的為XY,女的為XX。普遍而言,23對的染色體一半是來自父親,另一半來自母親,是平等的。但如因某種原因細胞得到了不平衡的染色體,那麼胎兒便發展得不正常。例如,如果是有三條 Chromosome 21又稱 Trisomy 21,嬰兒便有唐氏綜合症;或是如有三條 Chromosome 13,即巴陶氏症,那麼胎兒的腦部和其他器官的發育會有問題。
(4) 每個染色體內載有去氧核醣核酸 (Deoxyribonucleic Acid—縮寫:DNA)23 對染色體內的 DNA 如果是全部拉直的話,那麼總長度大約是兩米。
(5) 染色體是如此的細小,而 DNA 卻是如此之長,那麼 DNA 是如何藏在染色體內呢?答案就是它們會捲或交纏在一起的。概念就是 DNA 像是一條線,而在線上串連的是一些蛋白質,好像一串珠子 (beads and string)。
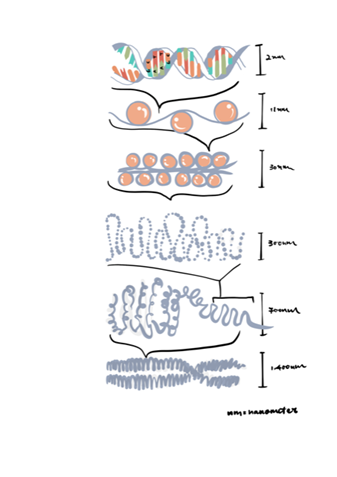
而經過無數次重複的的纏繞便內藏於染色體內。
(6) DNA的結構呈雙螺旋狀。
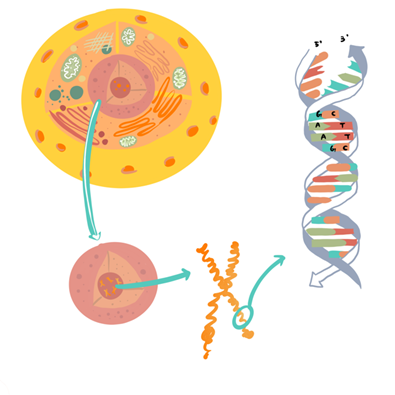
而DNA的最基本組成單位為「base」 (鹼基),分別是A (Adenine),C (Cytosine),T (Thymine),G (Guanine)。它們倚循一定的規律相配形成鹼基對 (Base Pair):A 與 T 相配; C 與 G 相配。
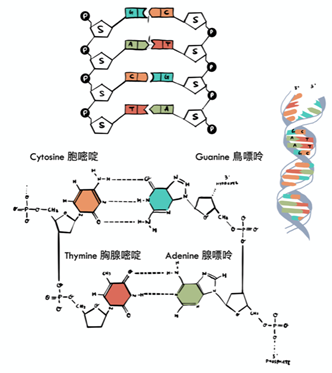
人一共有 60 億鹼基 (即30億鹼基對),加起來就稱為人類基因組。一半來自父親,另一半來自母親。DNA可以說是每個生物的遺傳密碼圖譜。
(7) 在整條 DNA當中,只有大約一個百分點的 DNA 是能夠被編碼成為蛋白質,主宰細胞的功能繼而展示生物的一些重要的特徵,如瞳孔的顏色。
這些 DNA 即是基因 (Gene),在人類當中大約有 20,000 個基因。其餘 99%是不能被編碼成為蛋白質。名叫Non-coding DNA。以前 Non-Coding DNA 被稱為Junk DNA,因為認為它們沒有任何用處。近年來,科學家已經認為它們是帶有一些調節的功能。
*****
一些有趣的知識:
- 人作為萬物之靈,是否基因組的大小在萬物中也最大呢?
答案不是──有些動物,例如鯊魚擁有比人類更大的基因組,甚至是有一些植物的基因組也比人類的大。 - 黑猩猩 (Chimpanzee) 有 98% 的基因是和人類相同的。
- 一個人和另外一個人的基因組是有 99.9% 相同,但差異的 0.1% 已足以令大家如此不同。
- 在遠古的動物遺骸也能尋找到 DNA,例如在西伯利亞冰封的環境,便能找到已滅絕的長毛象 (Mammoth) 的 DNA。至於恐龍,則由於年代實在是太久遠而沒法找到了。

第二部分──從基因角度解釋人為什麼會生癌?
人為什麼會生癌?
王:教授,一個最基本的問題──就是人為什麼會生癌呢?
盧:一個人生癌是因為正常細胞產生突變 (mutation)。正常的細胞有自己的功能,並會有規律地生長、分裂和死亡。 但是癌細胞則會不受規律地分裂,而且它們吸取養分和生長能力與速度均比正常細胞快得多。如果不能在它們出現的初期消滅它們,隨着時間的流逝,身體內的癌細胞將會越來越多並瘋狂分裂,排斥正常細胞。
如果癌細胞最先生長於肺部 (即是原位癌),那麼首先它們會令肺部正常的細胞不能做本來的工作、繼而死亡而破壞病人的肺功能。更壞的情況則是癌細胞擴散到其他器官,這就是俗稱「走散」或是癌細胞轉移 (metastasis),那麼治愈的機會便大大降低。
基因變異導致癌變的過程
王:教授,我想從「基因」角度了解一下癌症的成因。
我了解一個人是有自己的基因圖譜。那是不是一個人的每一個細胞的基因圖譜都是一模一樣的呢?一個人有那麼多不同的器官 (例如肺、心臟),那麼不同器官內的細胞的基因是不是一樣的呢?
盧:每個人的 DNA 最基本組成單位為「鹼基」(Base),分別是 A (Adenine),C (Cytosine),T (Thymine),G (Guanine)。他們依循一定的規律相配形成鹼基對 (Base Pair)。A 與 T 相配; C 與 G 相配。
基本上,一個人身體內所有細胞的 DNA 都是一樣的。如上述所講,一半的 DNA 是來自媽媽,另一半的是來自爸爸。但在不同器官的細胞裡,DNA 上基因的表達 (gene expression) 卻可以不盡相同。這就比一間新落成的大廈,一共有30層;每層有一個單位;而每個單位都是 1000 尺和三房一廳。每個單位的間隔完全相同,但卻有獨特的裝修,例如是「英倫風」、「中國風」等等。這種不影響 DNA 序列卻能改變細胞表徵的機制通稱「表觀遺傳學」(Epigenetics)。
在人類的 DNA 當中,有約二萬個基因。每一個基因的作息都是受到一系列的嚴密機制所掌控。有些基因在某些細胞內會運作,但卻在另一些細胞內則休息。從概念上簡單的解釋,就是肺的細胞是由1、3、5、7號的基因負責,但 2、4、6、8 號的基因則會休息。而心臟的細胞是由 2、4、6、8 號的基因負責,1、3、5、7 號的基因會休息。兩種細胞都有著 1-8 號基因,但這些基因卻在不同的細胞選擇性運作。這就像是一款智能手機的記憶系統內 (如DNA),裏面有不同的應用程式 (applications) (如基因),有些是讓我們拍照的 (如心臟)、有些則是讓我們看網上視頻的 (如肺部)。
但當這些基因在應該休息的程況下工作了,或因某些原因原本在工作中的基因變得更加活躍,那有可能產生癌症病變。

是先天還是後天?
王:這些比喻真是非常好!那麼請問癌症病變是基於先天還是後天的因素呢?
盧:兩者都有。
先天因素:
首先我們解釋一下先天的因素。
每個細胞都是不斷的生長、分裂、成為兩個細胞、兩個細胞又會再分裂成為四個細胞,如此類推。每次細胞分裂都會牽涉非常複雜的複製過程 (copy),如果在複製過程中有任何錯誤發生,那便產生基因變異了。基因變異當中有些是無害的,但有些卻使細胞得到了永生及不斷分裂的能力。這亦是生癌的開始。
當第一個細胞發生基因變異而成為癌細胞之後,它會分裂成兩個癌細胞,之後兩個癌細胞又分裂成為四個癌細胞,如此類推。而更有可能是這些癌細胞在每次分裂的時候,部份能累積到更多的基因變異,從而獲得更快的生長能力。這種「錯上加錯」的情況會使癌細胞變得更厲害。
王:那請問如果不考慮環境因素,是不是每一個人的細胞因「複製」而變異的機會是一樣的?
盧:不是。上天製造人的身體實在是非常奇妙的。每個細胞在複製的時候都具有數種「覆核」(proof read) 功能,以確認一下複製的過程中有沒有錯誤。但是在這方面,有一些人的細胞覆核的能力較遜,這樣在細胞複製過程中產生錯誤的機會便較大,從而令細胞突變的機會也增加了。
王:除了這個「複製」過程產生的問題,還有沒有其他先天因素呢?
盧:有的。
例如另外一個情況就是人有一個被名為 P53 的基因,是控制基因組的穩定性 (genome stability) 。如果一個人 P53 發生突變,便會較早生癌。
另外一個例子是有關腸癌的。當一個人做腸規鏡的時候,如果醫生發現腸內有瘜肉便會立即將它們切除,以防它們將來演變成為癌細胞。一般來說都是數粒之類。但是有一個名叫 APC 的基因,如果它突變的話,病人的大腸內會滋生極大量的瘜肉,可以是數百甚至是數千粒的。當然瘜肉的數目越多,將來演變成為腸癌的機會亦大大增加了。

後天因素:
王:以上談的是先天因素,那麼後天因素又如何?
盧:後天因素也是重要的。
一個例子就是以前一些建築工人要做石棉工程,而石棉是會釋放一些有毒的物質,這些有毒物質進入工人的體內便會令細胞 (特別是肺部外膜細胞) 病變,身體內的白血球便企圖去消滅它們。在在這個過程中細胞會死亡、分裂、再死亡⋯⋯導致發炎及產生更多病變,久而久之就會發展成為癌症。
醫生常常叫人不要吸煙也是基是於這道理。香煙含有焦油這種化學成份,積聚在身體內會誘發癌變。曬太陽也是一樣,太陽中的紫外光也會令皮膚細胞產生病變因而引起皮膚癌。
這些都後天因素致癌的例子。

王:那麼壓力 (stress) 又如何?常常聽說如果一個人精神長期受壓,會較容易生癌。這有科學根據嗎?
盧:這是一個複雜的問題,其中的機理我們也未能完全解釋,有極多的因素需要考慮。但是簡單來說,我們了解當一個人的情緒受壓,身體便會產生一種荷爾蒙叫皮質醇 (cortisol),而這種荷爾蒙的一個特質就是會令我們的免疫系統活躍度降低 (immune-suppression)。那麼如果一個人的免疫系統長期受壓的話,當然不能發揮好的作用,而令一個人更容易患上各類疾病 (包括癌病) 了。
年齡的因素:
王:患癌的機會是不是隨着年齡而遞增?
盧:是的。這可以從不同角度解釋得到。
第一:一個人出生的時候狀態是最好的,可以說成一個人的「黃金標準」(gold standard)。
第二:細胞分裂/複製時會產生錯誤。隨着一個人長大,錯誤便越積越多。
第三:隨着年齡增長,一個人的身體是會積聚/接觸越來越多的致癌物 (carcinogen)。而當這些致癌物質積聚到達某一個水平便會產生細胞變異,亦即是生癌的開始。就如我們以上談到石棉工人例子。
第四:一個人越老免疫系統的效率便越低,所以即使身體有癌細胞,免疫系統也不能有效的去清除它們。
所以也能把癌症說成是一種衰老病 (aging disease)。
王:所以一個人患癌可能有很多不同因素,醫生也未必能夠很確切的找出答案。既然如此,我們不如不要花太多時間和力氣去尋找確實的答案,而留下精力和醫生一起尋找一個最適合的治療方案。

第三部分──如何用基因技術來確診/監察/治療癌症?
分子診斷/ DNA 診斷
王:教授,請容許我由基本問起,什麼是「分子診斷」 (molecular diagnostics),又什麼是「DNA診斷」?
盧:「分子診斷」就是用技術分析分子 (molecules)。 DNA 是一種分子;所以「DNA 診斷」是「分子診斷」的一種。蛋白質也是一種分子,所以也可以用作「分子診斷」。
現在在市場上一般來說的「分子診斷」都是指「 DNA 診斷」。
王:教授,我知道大概 20 多年前是由你發現在媽媽的血液裡能找到胎兒的游離 DNA (circulating cell-free DNA) 的現象。這個發現把產前檢測引領到一個全新的領域。如在檢測胎兒有否唐氏綜合症 (Down Syndrome) 這種遺傳病,在你的研究發現之前,只能靠抽胎水這種較為侵略性的檢測才能確認,但現在則只需要孕婦數毫升的血液便能準確的,無侵略性的檢測到。
請問可不可以幫我們解釋一下這方面的知識?
盧:DNA 是我們生命特質的標記,在人與人之間,基本上 99.9% 的 DNA 都是相同的。而我們和黑猩猩 (chimpanzees) 的則是 98% 相同。
傳統上的思維一直是 DNA 是存在細胞核 (nucleus) 內的,就好像是在電腦,資料是存放在中央處理器 (CPU) 內的。但是我們發現到除此之外,竟然能夠在血液內找到浮游的 DNA。
而更令人驚訝的是我們在孕婦血液之內,不僅是找到她自己的 DNA,還能找到胎兒的 DNA。以一個孕育到 10 週的胎兒為例,我們在它媽媽的血液中已能發現到有高達 15% 的 DNA 是屬於胎兒的。
從這些 DNA 裏,我們能夠分析到很多有關胎兒的資料,包括:
- 性別;
- 血型組合;
- 導致遺傳病的基因;
例如剛才談到的唐氏綜合症就是染色體 21 出了問題。一個正常胎兒是應該有兩條染色體 21的,但如果有三條就是 trisomy21,那便會產生唐氏綜合症這種遺傳病了。這些胎兒出生後會較常人有更多先天結構及智商的問題。另外,若遺傳了三條染色體 13 或染色體 18 ,亦會引致巴陶氏症及愛華氏綜合症等遺傳病。
還有的就如在我們中國人之中較普遍的地中海貧血症 (thalassemia) 及由徐立之教授發現導致囊腫性纖維化病 (cystic fibrosis) 的基因。
所以簡單來說,我們可以從孕婦血液當中檢測到很多關於她及其胎兒的「生命特質標記」。

如何運用DNA 技術診斷癌症?
王:那麼我們如何能夠運用 DNA 技術來診斷癌症呢?
盧:我們可以從兩個角度來分析——第一就是診斷一個正常人是否患上癌症;第二就是癌症病人在康復後癌症是否有復發的跡象。
診斷一個正常人是否患上癌症
盧:癌細胞的出現是因為 DNA 內有突變。DNA 控制細胞生長的行為,所以當 DNA 有突變的時候,細胞便能擁有不斷分裂,不死,擴散的能力,成為癌細胞。
所以我們可以從 DNA 的突變去診斷一個人是否患上癌症或者將來會患上癌症的機會。
癌症病人在康復後癌症是否有復發的跡象?
盧:當一個病人的癌症是因為特定的基因突變而產生,醫生便可以用標靶藥去針對該基因突變去治療病人。在治療之後病人雖然病情受到控制,但基因又可以再突變而令病情惡化。所以我們便要「追踪」病人血液中的 DNA 是否再有新突變的跡象。一旦發現便要立即採取行動,例如是轉用另外一種標靶藥。
如何能用DNA技術確診/監察/治療癌症?
王:教授請問現在在什麼領域內我們能夠用 DNA 技術去確診/監察/治療癌症?
盧:現在已經發展到可以應用的是一些比較容易掌握的範疇。
第一個例子就是在鼻咽癌方面。我們現在已經能夠利用技術檢測到病人生癌是因為受到 EB病毒感染。若病人血液裡的 EBV DNA 長期的偏高,那便需要進行更多檢查去尋找該病人有否鼻咽癌,盡早進行適當治療。同時在病人康復之後,亦可用 DNA 技術去繼續監察。
另一個例子就是在肺癌方面。有一類肺癌是因為一隻名叫 EGFR 的基因突變而引起的,我們知道後便可用標靶藥針對治療,之後亦可用 DNA 技術繼續監察。
而在乳癌方面,有某一種乳癌是和一隻名叫 HER2 的基因有關。這個基因在正常人的細胞裡是應該只有兩個的,但是在癌症病人身體內卻因基因突變而變出更多 HER2。HER2 過度表現 (over-expression) 會令癌細胞不斷增生及變得更具侵略性。在有了這個發現之後,科學家開發了一種針對這種 HER2 過度表現的新藥去治療 HER2+ve 的乳癌,這就是 Herceptin。而在這種新藥面世之後,HER2+ve 的乳癌病人的生存率獲得大大提高。
長遠來說我們一定是越來越多利用 DNA 技術去確診/監察/治療癌症。
王:我記得十多年前,患有肺癌的病人都是很快去世的,而現在則可見到一些病人的存活期可以較以前長很多。這是因 DNA 技術的發展嗎?
盧:是的。第一是 DNA 技術能夠令癌變在很早期已經獲得確診——由於當時病人身體內癌細胞的數量較少,所以醫生能夠用最有效的治療迅速把它們殲滅。例如在 2017 年,我們曾經做過一項研究,就是用 DNA 技術追踪 34 名有鼻咽癌復發可能的人士的情況,結果到現在,除了一位之外,其他還是健康良好。
第二就是標靶藥的迅速發展——現在醫生已有不同的標靶藥去針對性的治療不同的基因突變。有時甚至可以用「雞尾酒」形式治療,同時針對多於一個基因突變,更有效地剷除癌細胞。
王:請問現在這些技術是不是已經在現實世界中普遍得到應用?換句話說已經成功脫離科硏階段?
盧:在肺癌方面,利用針對 EGFR 基因有關的標靶治療已經在全世界非常普及。
在鼻咽癌方面,利用有關 EB 病毒的技術在「監察病情」方面已經在很多醫院應用。而在普查 (screening) 方面,在 2017 年我們的團隊在新英倫醫學雜誌 (New England Journal of Medicine) 發表了一份有關於這方面的研究的文章,希望將來能夠普及應用。
免疫治療
王:近年來我們聽到一種較新的治療,就是免疫治療,可否替我們解釋一下?
盧:免疫治療 (immunity treatment) 就是通過喚醒病人自己的免疫系統去殲滅癌細胞。
細胞如有基因突變便會變成癌細胞,越多基因突變情況就越複雜和難於處理。但是從另一個角度來看,如果基因突變真的很多,免疫系統便能更容易知悉它們的存在。這類病人可能更適合免疫治療。
在免疫治療方面,我們有一個指標就是腫瘤突變負荷量 (Tumour Mutation Burden),越多基因突變指數便越高;而病人就有較大機會適合免疫治療。這是從好一方面來看。
但從另外一個角度來看,基因突變越多,病人情況便越複雜和不穩定,從而難於醫治。現時免疫治療有效醫治的癌症個案大概只有 15%,這個數字還是較為低的。
由於情況複雜,醫生便要為病人「度新訂造」治療方案,這就是所謂個性化治療(Personalized Medicine)。
第四部分──展望未來
王:教授,我們都可以肯定將來會有很多資源被投放在癌症治療的科研,那你認為發展的方向大致會是如何呢?
盧:我估計會大致上有幾個發展方向。
第一就是在未來標靶藥會有很大的發展。
大家知道傳統化療是會在殲滅癌細胞的同時亦破壞正常細胞 (特別是一些分裂得快的細胞),所以它的弱點就是不夠準確 (not specific)。而能夠準確針對/殲滅癌細胞的標靶治療會是一個更好的選擇。
但是標靶藥亦有弱點——當某一種基因突變引致癌細胞生長的時候,其實已經可能同時亦有其他不同的基因突變。以肺癌為例,如果用標靶藥成功治療了 EGFR 病變之後,其他基因突變又冒起,便需要處理,否則病人的癌症便會復發。所以我相信將來會有很多資源投入標靶藥物的科研。
隨着時間科學家會越來越掌握到人類基因圖譜,例如知道某器官 (例如肺) 的癌細胞是由某幾種基因突變引起;而另一器官 (例如腸) 的癌細胞則是由另外某幾種基因突變引起……那麼藥廠便會投入資源去開拓,希望能發展出一系列的標靶藥去治療不同的基因突變。
第二就是免疫治療的發展。
免疫治療在近幾年得到很大的發展。研究發現,少部份人在經過免疫治療後,可以達到長達十年以上的病情控制,可以說是完全康復,亦是所謂「斷尾」。這是十分了不起的結果。可惜免疫治療現在大約只會對 15% 的癌症有效,而我們暫時亦未能完全掌握/預測免疫治療會對那些病人的效果特別好。所以如果能夠在這個領域發展,將會裨益很多癌症病人。
第三就是所謂CAR-T Cell 免疫療法的發展。
CAR-T Cell 免疫療法是一種利用基因工程 (genetic engineering) 的方法改造 T-cell (免疫細胞的一種),從而更有效的去對付癌細胞。這是一個非常新穎的治療領域。現時在美國已初有成果,但是價錢非常之貴,每一個療程可能是需要數十至數百萬元。
王:非常感謝盧教授今天和我們分享了這麼多關於基因治療癌症的知識!亦展望將來科硏會為我們的病人帶來更多治療方法和希望!
盧:不要客氣。
(於2020年9月定稿)




